医疗设备制造商遵循的基本《现行药品生产质量管理规范》(CGMPs)之一是稳健的制程验证程序。医疗OEM制造商通常在其运营中已采用了有效的制程验证系统;但是,合同制造商可能很难在其运营中采用有效的制程验证系统。本专栏文章将为合同制造商如何有效实施可持续的制程验证程序提供实用指南。稳健且实用的制程验证程序可以使合同制造商达到一致的、高质量的性能。
每个制造商都追求通过建立稳健的制程来促进业务发展,这些制程可以帮助他们生产出符合客户图纸规范和采购订单要求的、质量一致且可靠的部件。这句话听起来很简单,但实施起来却可能是一项艰巨的任务。在过去20年中,经过对100多家工厂的审核、管理或咨询,我发现了顶级制造商都拥有的共同特质。顶级制造商在实施、验证和监控制程方面都拥有一致的切实有效的方法。合同制造商可以通过稳健而有效的制程验证程序显著提高部件的质量和一致性。
在我们评估有效的制程验证方法之前,了解验证的质量体系要求非常重要。《ISO 9001:2015标准》第8.5.1条“关于生产和服务提供的控制”要求,“对无法通过后续监测或测量确认其输出结果是否达到计划结果的生产和服务能力进行验证和定期重新验证。 ”在航空航天和医疗设备等受监管的行业中,《AS9100D航空航天标准》第8.5.1.2条“特定工艺的验证和控制”、《ISO 13485:2016医疗设备质量管理体系》第7.5.6条“生产和提供服务流程验证”,都规定了特定制程验证要求。
食品药品监督管理局(FDA)将制程验证作为CFR 820.75(a)中的监管要求,为行业补充了制程验证指南——《现行药品生产质量管理规范》(CGMPs)制程验证:基本原则和规范。这些标准和规范提供了有关要求的通用指南,但没有具体说明应如何实施,要求每个制造商都要开发最适合其制造环境的方法。制造商有机会实施可持续且有效的制程验证程序,不仅要符合标准,更重要的是为制造商确保生产制程一致性和产品质量可靠提供保证。
如何实施有效的制程验证程序? 让我们首先了解制程验证和制程确认之间的区别。方法之一是了解食品药品监督管理局(FDA)如何定义这些要求。 根据《联邦法规》,第21章——食品和药品,第820部分,质量体系法规:
- 验证是指通过审查并提供客观证据,证实可以始终如一地满足特定用途的特定要求[CFR 21 Part 820.3(z)]
- 确认是指通过审查并提供客观证据,证实已满足特定要求[CFR 21 Part 820.3(aa)]
当这些定义应用于制造运营时,我们得出结论,并非所有制程都可以被确认。从理论上讲,您可以验证所有制程,但这对公司而言并不符合成本效益。制程验证应仅适用于无法完成确认的制程(图1)。

图1:要求验证的制程很少
需要验证的典型制程是热处理、洁净室环境条件、电镀、注塑成型、灭菌和包装密封工艺。制造商应准备一个表,列出所有制程,并为每个制程定义度量,如图2所示。
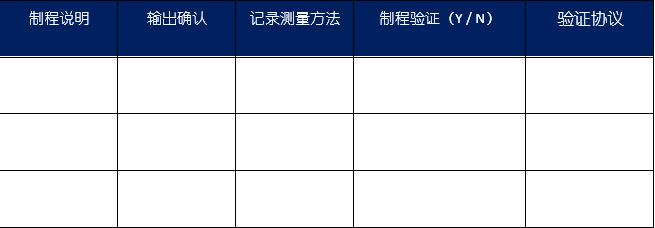
图2:将每个制程分类为需要验证还是确认的推荐方法
要求验证的制程,应该经受稳健的验证程序,为每个阶段采用验证协议。验证阶段包括:
- 安装鉴定(IQ):此验证阶段确认是否已按照制造商的规格交付、安装和配置经鉴定合格的仪器或设备以及其子系统和任何辅助系统。
- 操作鉴定(OQ):此验证阶段检查设备的性能是否符合制造商指定操作范围内的用户要求规范。 测试计划中的所有项目均单独测试,并记录其性能。
- 性能鉴定(PQ):最终验证阶段包括确认并记录设备在指定工作范围内可重复工作。
表1列出了一个实际的事项清单,应视为每个阶段的适用要求。制造商应定义每个事项的文档范围,建议保持简单性,以便于实施和具有可持续性。

表1:为每个阶段创建验证协议时需考虑的事项
通过产品良率一致性和在验证制程中降低的工艺变化率来衡量制程验证程序的有效性,其中安装鉴定(IQ)、操作鉴定(OQ)和性能鉴定(PQ)协议在制程应用到生产之前完成。制程验证审核应定期执行,并纳入制造商的标准管理审核程序。采用这种方法进行制程验证的公司将可达到更高一致性的产品质量和客户满意度。在评估制造商的风险时,客户对制程验证程序具有重要价值。
Alfred Macha是AMT Partners公司的总裁,这是他在本期杂志发表的第一篇专栏文章。期待Alfred在未来发表更多文章。可通过电子邮箱Alfred@amt-partners.com与他联系。


